Изучение дискретного строения вещества в физике средней школы
![]()
Моль служит для образования производных молярных величин, в частности, молярной массы. Определяющее уравнение молярной массы имеет вид:
![]() ,
,
где M - молярная масса однородного вещества;
m - масса однородного вещества;
![]() - количество вещества.
- количество вещества.
Молярная масса - это физическая величина, определяемая отношением массы однородного вещества к его количеству.
Молярная масса показывает, какова масса одного моля однородного вещества.
Чтобы получить единицу молярной массы СИ, надо в определяющее уравнение молярной массы подставить единицы массы - 1 кг и количества вещества - 1 моль.
Получаем:
![]() .
.
Молярная масса связана с относительной молекулярной массой соотношением:
![]()
Значения приведенных величин позволяют путем вычислений оценить порядок величины размеров молекул.
Если считать, что молекулы в жидкости упакованы плотно и каждая из них вписывается в куб объемом V1 с ребром d, то
![]()
Объем одной молекулы связан с объемом Vm одного моля жидкости и числом Авогадро NA соотношением:
![]()
Объем одного моля жидкости выражается через ее молярную массу М и плотность ![]() :
:
![]()
Таким образом, диаметр молекулы равен:
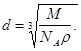
Для воды:
![]()
![]()
Вычисляя, имеем:
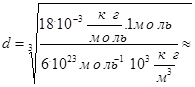
![]()
Из приведенных выше сведений любопытным является вопрос о происхождении числа Авогадро. Действительно, невозможно вообразить, что это число принципиально могло бы быть получено путем непосредственных подсчетов. Тогда встает вопрос: а как оно было найдено опосредованными методами?
История вопроса примерно такова. В начале XIX в Гей-Люссак на опыте установил закон, согласно которому при химических реакциях соединение газов всегда происходит таким образом, что один объем одного газа соединяется только с кратными объемами другого газа.
Объясняя результаты опытов Гей-Люссака, итальянский ученый Авогадро в 1811 г. выдвинул гипотезу о том, что при одних и тех же температуре и давлении равные объемы газов содержат одно и то же число молекул. Будучи согласованной с рядом других сведений, полученных химиками, гипотеза Авогадро в дальнейшем получила статус закона.
Закон Авогадро можно сформулировать и следующим образом: 1моль любого вещества в газообразном состоянии при одинаковых давлении и температуре занимает вполне определенный объем. При нормальных условиях (p = 101,325 Па и t=0oC) этот объем равен примерно 22,4 л.
Из закона Авогадро следует, что отношение плотностей газов, взятых при одних и тех же условиях, (макроскопических и непосредственно измеряемых величин), равно отношению масс их молекул, (микроскопических и непосредственно неизмеряемых величин). Это отношение позволяет сравнивать массы молекул, так как плотность газа равна произведению концентрации n (числа молекул в единице объема) на массу одной молекулы m0 :
![]()
![]() .
.
Закон Авогадро позволил определить и число молекул в моле любого вещества, получившее название числа Авогадро.
Впервые значение числа Авогадро определил в 1908 г. французский физик Перрен.
Идея метода Перрена строилась на гипотезе о том, что мельчайшие, взвешенные в жидкости частички, совершающие броуновское движение в поле тяготения, распределяются по высоте согласно тем же законам, что и молекулы газов, входящих в состав воздуха. В уравнение, показывающее, чему равно отношение плотностей газа на разных высотах, наряду с другими величинами, входит и масса молекулы. Зная, чему равны плотности различных газов на разных высотах, и измерив концентрацию броуновских частиц на разной глубине, можно сравнить массы молекул с массой броуновских частиц. Масса броуновских частиц, какими бы маленькими они ни были, величина измеряемая. Следовательно, подсчет числа, тщательным образом подготовленных, одинаковых по размеру, однородных броуновских частиц, в конечном счете позволяет определить массы молекул различных газов.
Информация по теме:
Народные культура и традиции – основа нравственного воспитания
Зачем в современном обществе нужно знания культурно-исторических традиций, нравственных норм которыми руководствовались наши далекие предки? Нужно ли это? Ведь сейчас совсем другое время и другие законы. Казалось, что на такие вопросы существуют естественные ответы. Культура и традиции - выражают с ...
Самостоятельная работа и её виды
На сегодняшний день нет необходимости убеждать преподавателей в важности разработки и внедрения в педагогическую практику более совершенных методик обучения, обеспечивающих повышение качества учебного процесса, способствующих активизации познавательной деятельности учащихся, развитие их умственных ...
Особенности психического и физического развития детей с нарушениями
интеллектуального развития
Дети с нарушениями интеллектуального развития характеризуются стойкими нарушениями всей психической деятельности, особенно отчетливо обнаруживающимися в сфере познавательных процессов. Причем имеет место не только отставание от нормы, но и глубокое своеобразие личностных проявлений, и познания. Так ...
Навигация
- Главная
- Методы обучения
- Семейное воспитание
- Роль игры в воспитании
- Знания, навыки и умения в процессе обучения
- Влияние среды на развитие личности ребёнка
- Нравственное воспитание в современном мире
- Педагогика
